10月23日,医学研究院卿国良教授课题组在Cell杂志子刊Molecular Cell (IF=13.958)上在线发表最新研究成果。文章报道了Polo样激酶1(PLK1)与癌蛋白MYC之间形成正向反馈调控的分子机制,并提出一种联合给药靶向治疗肿瘤的新模式。这项研究不但揭示了癌症发生发展的新机制,而且为精准治疗MYC高表达癌症的临床研究提供了重要的科学依据。
该论文题为Polo-like Kinase-1 Regulates Myc Stabilization and Activates a Feedforward Circuit Promoting Tumor Cell Survival。医学研究院卿国良教授为该论文的通讯作者,博士后肖代彪为该论文的第一作者。
癌基因MYC(编码癌蛋白MYC)在超过70%的癌症中被异常激活。众多细胞水平和模式动物研究表明,癌基因MYC对肿瘤形成必不可少,干预MYC的表达或活性,可显著甚至完全抑制肿瘤的发生和发展。然而目前尚无直接靶向MYC的药物,进一步寻找替代策略靶向MYC势在必行。
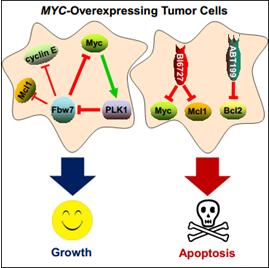
该研究成果揭示,PLK1与MYC形成正反馈信号环路,诱导癌症发生发展。在分子水平上,PLK1磷酸化E3泛素连接酶Fbw7,诱导Fbw7自身多聚泛素化降解,增强Fbw7促癌底物(如MYC、cyclin E、Mcl1等)的蛋白稳定性;同时,MYC作为转录因子能够直接激活PLK1 mRNA的转录表达,从而进一步稳定放大MYC的促癌活性。靶向PLK1可打断这一正反馈环路,促进肿瘤细胞凋亡。
激酶抑制剂的抗肿瘤功效易发生耐药,常常考虑联合用药的策略。Bcl2抑制剂ABT199已被美国FDA批准上市,其抗肿瘤效应依赖于癌细胞中Mcl1的低表达,而众多癌细胞中Mcl1常常出现高表达,这就限制了Bcl2抑制剂的临床应用。此项研究发现,抑制PLK1不仅下调MYC而且降低Mcl1水平,首次提出PLK1抑制剂与Bcl2抑制剂联合用药可有效协同治疗MYC高表达的肿瘤。更为可喜的是,PLK1抑制剂BI6727已进入美国FDA绿色加速通道的临床试验用于治疗急性髓系细胞白血病;这两种靶向药物的联合使用有望为肿瘤的精准治疗开辟新天地。
该研究工作获得国家自然科学基金面上项目的支持。
上一条:《细胞研究》发表钟波课题组翻译后修饰调控抗病毒天然免疫分子机制的最新成果
下一条:舒红兵研究组发现抗病毒天然免疫动态调控机制相关成果在《细胞•免疫》发表