地中海贫血症(地贫)是由于β-血红蛋白编码基因HBB发生突变,导致血红蛋白异常,患者需要终身持续输血的遗传病。在我国,约有30万重型和中型地贫患者。已有研究表明,重激活胎儿血红蛋白,可以缓解甚至治愈地贫。基于此,CRISPR Therapeutics公司和福泰制药联合开发的第一代基因编辑核酸酶破坏BCL11A红系增强子,以实现重激活胎儿血红的替代疗法正式获批进入市场。然而此策略仍有不足之处,Cas9核酸酶会产生DNA双链断裂,存在一定的安全性风险。此外,临床数据显示,个别患者接收治疗后仍然需要持续输血辅助治疗,提示有效性不足。因此,需要进一步探索更安全、更高效重激活γ-珠蛋白的新策略。
2023年11月21日,武汉大学医学研究院/免疫与代谢前沿科学中心张楹教授团队与合作者在国际学术期刊Cell Stem Cell在线发表了题为“Base editing of the HBG promoter induces potent fetal hemoglobin expression with no detectable off-target mutations in human HSCs”的研究论文,介绍了其在基因编辑治疗地中海贫血症领域的最新研究成果。

图1. 变形金刚大黄蜂代表研究中使用的变形式碱基编辑器(transformer base editor, tBE),它攀登DNA梯子,将不健康的贫血细胞替换为健康的红细胞。
研究人员采用了低脱靶的胞嘧啶碱基编辑器(tBE),系统性优化了tBE的RNA表达系统及电转递送方法,大幅度提高了tBE在造血干细胞中的编辑效率。通过筛选比较可以提高胎儿血红蛋白的多个位点,发现直接破坏BCL11A在HBG1/2启动子的结合基序,可产生最高表达水平的γ-珠蛋白。进一步地,研究人员在健康人或地贫患者来源的造血干细胞中将tBE编辑策略与其它临床或临床前基因编辑方法进行了比较,在产生了近乎相同水平编辑效率的条件下,tBE编辑新靶点所激活产生的胎儿血红蛋白水平显著高于现有临床获批策略。最后,研究团队对编辑过程中的脱靶事件进行了全面评估。由于碱基编辑器不产生DNA双链断裂,细胞体内不激活p53通路,且脱靶率低,安全性更高。
综上,该研究证明了通过tBE靶向编辑位于HBG1/2启动子上的BCL11A结合基序,是更为精准有效且更加安全的激活γ-珠蛋白表达的策略,为地贫的临床治疗提供了新方案。
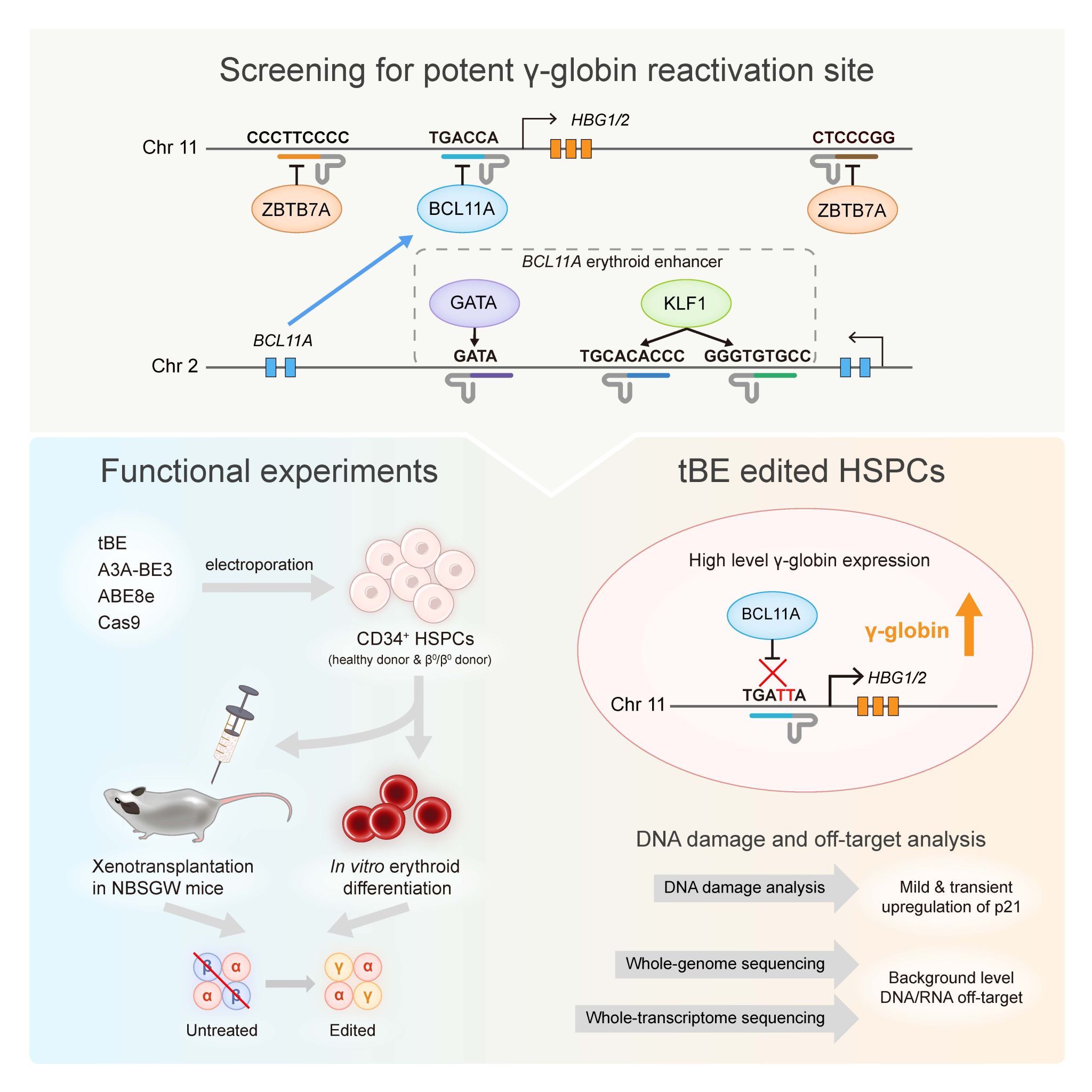
图2. 本研究主要步骤示意图。
上海科技大学韩炆艳研究生、武汉大学医学研究院邱厚圆研究生、上海科技大学孙尚武研究生、复旦大学付志灿研究生、武汉大学医学研究院王国权研究生、复旦大学儿童医院血液肿瘤科钱晓文医生为该论文共同第一作者。武汉大学张楹教授、上海科技大学杨贝教授、上海科技大学陈佳教授及复旦大学杨力教授为该论文共同通讯作者。该研究还得到了武汉大学医学研究院仪器设备共享中心、复旦大学儿科医院血液肿瘤科翟晓文教授及正序(上海)生物科技有限公司的大力支持。
原文链接:
https://doi.org/10.1016/j.stem.2023.10.007





 武大主页
武大主页 信息门户
信息门户 英文版
英文版 旧版入口
旧版入口