微管骨架在细胞极性、胞内物质运输和细胞分裂等生物学过程中发挥重要作用。微管正端与负端的空间分布共同决定微管网络的整体形态与功能。在细胞分裂间期,微管正端通常朝向细胞边缘,与细胞皮层结合。由CLASPs、liprins、LL5β、KANKs和ELKS等主要蛋白组成的复合物在微管正端被皮层捕获与稳定过程中起关键作用,因而被称为皮层微管稳定复合物(cortical MT stabilization complex,CMSC)。细胞内微管负端通常被锚定于微管组织中心(MT organizing centers, MTOCs),处于稳定状态。而微管组织中心的位置最终决定微管网络的极性取向。
目前虽然已有大量微管正端结合蛋白被鉴定,已知的微管负端结合蛋白仅少数几个,其中包括CAMSAPs/Patronin家族蛋白。CAMSAPs/Patronin结合并稳定非中心体微管负端,通过与不同的接头蛋白结合,被锚定于细胞类型特异的非中心体微管组织中心。但是除了正向锚定机制,是否存在非中心体微管负端空间分布的负调控机制尚不清楚。

2023年4月5日,武汉大学医学研究院/免疫与代谢前沿科学中心/口腔医学院姜恺团队在The EMBO Journal杂志上发表题为The CEP170B-KIF2A complex destabilizes microtubule minus ends to generate polarized microtubule network的研究论文。该研究鉴定CEP170B为新的微管负端结合蛋白,阐明CEP170B与上游因子Liprin-α1及下游因子KIF2A协同调控非中心体微管负端极性分布的功能,并揭示CEP170B-KIF2A复合物拮抗微管负端稳定因子CAMSAPs的分子机制。
该研究中,课题组通过亲和纯化-质谱鉴定出CEP170B这一之前未被研究的蛋白为皮层斑的新组分。免疫荧光实验显示CEP170B富集于细胞皮层微管,该定位依赖于CMSC复合物组分Liprin-α1的招募并受到蛋白磷酸酶PP2A的调控。进一步通过活细胞成像实验仔细观察发现CEP170B还能结合游离微管的负端。CEP170B基因敲除细胞系中的免疫荧光实验结果表明CEP170B可抑制CAMSAP2/3结合的微管负端在HeLa细胞边缘和极化上皮细胞的基底层聚集,从而决定非中心体微管负端的极性分布,并影响分泌囊泡的定向运输以及三维胞囊(cyst)的形成过程。
课题组继续通过亲和纯化-质谱寻找到CEP170B下游协作因子Kinesin-13家族微管解聚酶KIF2A。KIF2A基因敲除细胞系中的免疫荧光实验结果表明KIF2A可与CEP170B协同调控CAMSAP2结合的非中心体微管负端的空间分布。为揭示CEP170B发挥功能的分子机制,课题组进行了体外重组研究。结果发现CEP170B具有自发的微管负端结合活性,与KIF2A一起可形成微管负端特异的解聚酶,共同拮抗CAMSAP2/3对微管负端的保护作用,引起微管负端解聚。
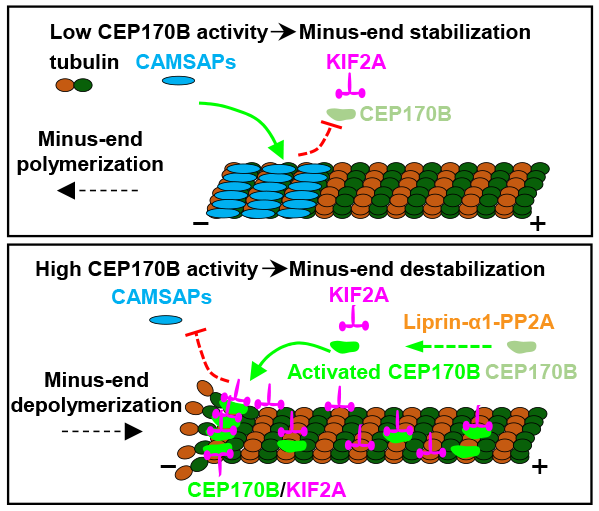
图. CEP17B-KIF2A复合物在微管负端拮抗CAMSAPs的模式图
综上,该研究鉴定CEP170B为新的微管负端结合蛋白,并揭示了一个全新的非中心体微管负端空间分布的负调控机制。
武汉大学医学研究院/免疫与代谢前沿科学中心博士生关翠荣为文章的第一作者,姜恺教授为文章通讯作者。该研究得到了国家自然科学基金委和中央高校基本科研业务费专项资金的资助。
论文链接:https://www.embopress.org/doi/10.15252/embj.2022112953





 武大主页
武大主页 信息门户
信息门户 英文版
英文版 旧版入口
旧版入口