(转自武汉大学新闻网讯)(通讯员刘雨田子)2月10日,武汉大学医学研究院刘胡丹教授课题组在著名学术期刊Cancer Cell(《癌细胞》)发表了题为“Direct Phosphorylation and Stabilization of MYC by Aurora B Kinase Promote T-cell Leukemogenesis”的研究成果,报道了癌蛋白MYC的新型磷酸化修饰促进急性T淋巴细胞白血病 (T-ALL) 发生发展的分子机制以及干预MYC治疗T-ALL的潜在新策略。
T-ALL是一类恶性程度极高的血液肿瘤,目前临床治疗方案以大剂量的化疗为主。虽然儿科患者治愈率较高,但是高强度化疗导致的毒副作用常常伴随终生,而且患儿后期复发率较高。成年患者则因无法耐受高强度的化疗导致预后较差,因而迫切需要高效低毒的靶向治疗方案。癌蛋白MYC是驱动T-ALL发生发展的关键因子,可作为治疗T-ALL的潜在新靶点。然而,由于MYC蛋白结构松散,缺乏适于小分子结合的功能域,导致直接靶向难以成行,目前只能寻求间接靶向的策略。
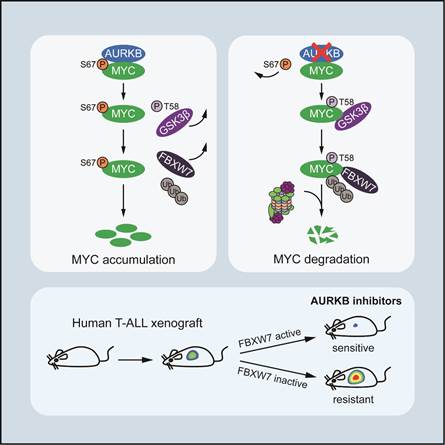
通过前期的蛋白质组学筛选,刘胡丹课题组发现蛋白激酶Aurora B (AURKB)能够直接结合MYC,并磷酸化其67位丝氨酸残基 (S67)。进一步机制研究表明,S67磷酸化阻碍了MYC与GSK3β相互作用,从而抑制MYC 58位苏氨酸 (T58) 磷酸化及E3泛素连接酶FBXW7的识别,显著增强了MYC蛋白的稳定性;同时,MYC直接激活AURKB的基因转录,形成正反馈环路放大MYC的致癌功能。
通过T-ALL转基因斑马鱼模型,研究人员进一步证实AURKB-MYC正反馈调控轴对T-ALL发生发展至关重要。随后,通过筛选美国FDA小分子化合物文库,研究人员发现T-ALL临床一线治疗药物长春新碱协同AURKB抑制剂AZD1152,发挥显著的抗白血病功效。尤为重要的是,该联合用药仅选择性致死FBXW7野生型的T-ALL,而对带有FBXW7失活突变的T-ALL疗效甚微,提示FBXW7基因突变可作为该联合用药治疗T-ALL的潜在生物标志物。
值得一提的是,传统理论认为MYC 62位丝氨酸 (S62) 磷酸化水平升高与MYC蛋白稳定性增强呈正相关,但同时S62磷酸化也会协助MYC与GSK3b结合,介导T58磷酸化以及MYC泛素化降解。本项研究工作提出了MYC S67磷酸化拮抗GSK3b结合从而增强MYC蛋白稳定性的新机制,并证实其在T-ALL发生发展过程中的重要功能。
刘胡丹为该论文的通讯作者,武汉大学医学研究院博士研究生江珏、王敬超和华中科技大学附属武汉市中心医院岳明博士为共同第一作者。该研究工作受到国家重点研发计划和国家自然科学基金的资助。
原文链接:https://doi.org/10.1016/j.ccell.2020.01.001





 武大主页
武大主页 信息门户
信息门户 英文版
英文版 旧版入口
旧版入口